یوروپیوم، نماد Eu و عدد اتمی ۶۳ است. به عنوان یک عضو معمولی از لانتانیدها، اروپیم معمولاً دارای ظرفیت +۳ است، اما ظرفیت اکسیژن +۲ نیز رایج است. ترکیبات کمتری از اروپیم با حالت ظرفیت +۲ وجود دارد. در مقایسه با سایر فلزات سنگین، اروپیم هیچ اثر بیولوژیکی قابل توجهی ندارد و نسبتاً غیرسمی است. اکثر کاربردهای اروپیم از اثر فسفرسانس ترکیبات اروپیم استفاده میکنند. اروپیم یکی از کم فراوانیترین عناصر در جهان است. تنها حدود ۵ عدد از آن در جهان وجود دارد × ۱۰-۸٪ از ماده، اروپیم است.
یوروپیوم در مونازیت وجود دارد
کشف اروپیوم
داستان از اواخر قرن نوزدهم آغاز میشود: در آن زمان، دانشمندان برجسته با تجزیه و تحلیل طیف نشری اتمی، شروع به پر کردن سیستماتیک جاهای خالی باقی مانده در جدول تناوبی مندلیف کردند. از نظر امروزی، این کار دشوار نیست و یک دانشجوی کارشناسی میتواند آن را انجام دهد؛ اما در آن زمان، دانشمندان فقط ابزارهایی با دقت پایین و نمونههایی داشتند که خالصسازی آنها دشوار بود. بنابراین، در کل تاریخ کشف لانتانید، همه «شبه» کاشفان مدام ادعاهای دروغین میکردند و با یکدیگر بحث میکردند.
در سال ۱۸۸۵، سر ویلیام کروکس اولین سیگنال اما نه چندان واضح از عنصر ۶۳ را کشف کرد: او یک خط طیفی قرمز خاص (۶۰۹ نانومتر) را در یک نمونه ساماریوم مشاهده کرد. بین سالهای ۱۸۹۲ و ۱۸۹۳، کاشف گالیوم، ساماریوم و دیسپروزیوم، پاول ای مایل لوکوک دو بوابودران، این باند را تأیید کرد و باند سبز دیگری (۵۳۵ نانومتر) کشف کرد.
در مرحله بعد، در سال ۱۸۹۶، اوگ ای آناتول دمارچای با صبر و حوصله اکسید ساماریوم را جدا کرد و کشف یک عنصر خاکی کمیاب جدید واقع در بین ساماریوم و گادولینیوم را تأیید کرد. او با موفقیت این عنصر را در سال ۱۹۰۱ جدا کرد و پایان سفر اکتشاف را رقم زد: «امیدوارم این عنصر جدید را یوروپیوم با نماد Eu و جرم اتمی حدود ۱۵۱ بنامم.»
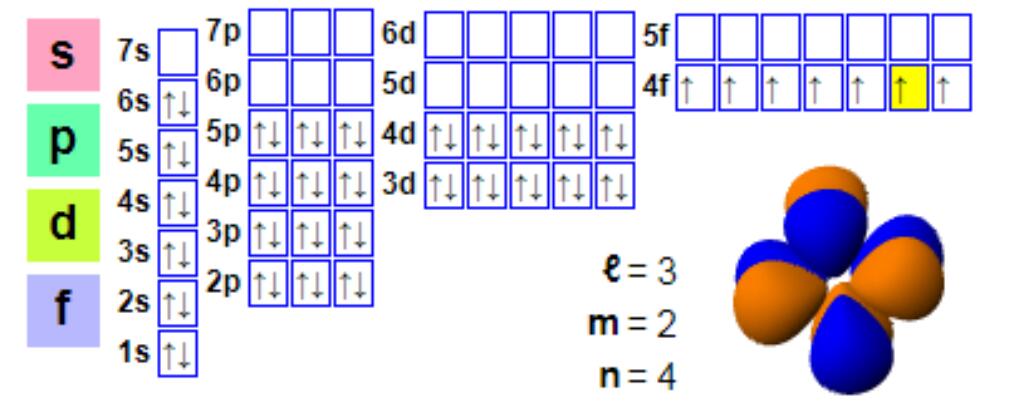
پیکربندی الکترونی
پیکربندی الکترونی:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p66s2 4f7
اگرچه یوروپیوم معمولاً سه ظرفیتی است، اما مستعد تشکیل ترکیبات دو ظرفیتی است. این پدیده با تشکیل ترکیبات ظرفیتی +3 توسط اکثر لانتانیدها متفاوت است. یوروپیوم دو ظرفیتی دارای پیکربندی الکترونی 4f7 است، زیرا پوسته f نیمه پر، پایداری بیشتری را فراهم میکند و یوروپیوم (II) و باریم (II) مشابه هستند. یوروپیوم دو ظرفیتی یک عامل کاهنده ملایم است که در هوا اکسید میشود و ترکیبی از یوروپیوم (III) را تشکیل میدهد. در شرایط بیهوازی، به ویژه شرایط گرمایش، یوروپیوم دو ظرفیتی به اندازه کافی پایدار است و تمایل دارد در کلسیم و سایر کانیهای قلیایی خاکی ترکیب شود. این فرآیند تبادل یونی اساس "ناهنجاری منفی یوروپیوم" است، یعنی در مقایسه با فراوانی کندریت، بسیاری از کانیهای لانتانید مانند مونازیت محتوای یوروپیوم پایینی دارند. در مقایسه با مونازیت، باستنازیت اغلب ناهنجاریهای منفی یوروپیوم کمتری از خود نشان میدهد، بنابراین باستنازیت نیز منبع اصلی یوروپیوم است.
اروپیم فلزی به رنگ خاکستری آهنی با نقطه ذوب ۸۲۲ درجه سانتیگراد، نقطه جوش ۱۵۹۷ درجه سانتیگراد و چگالی ۵.۲۴۳۴ گرم بر سانتیمتر مکعب است. این عنصر کمچگالترین، نرمترین و فرارترین عنصر در بین عناصر خاکی کمیاب است. اروپیم فعالترین فلز در بین عناصر خاکی کمیاب است: در دمای اتاق، بلافاصله درخشش فلزی خود را در هوا از دست میدهد و به سرعت به پودر اکسید میشود. با آب سرد به شدت واکنش میدهد و گاز هیدروژن تولید میکند. اروپیم میتواند با بور، کربن، گوگرد، فسفر، هیدروژن، نیتروژن و غیره واکنش دهد.
کاربرد اروپیم
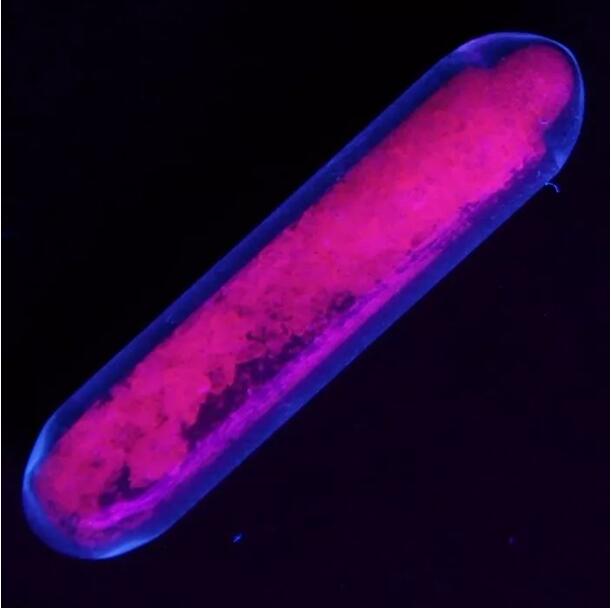
سولفات اروپیم در زیر نور فرابنفش، فلورسانس قرمز ساطع میکند.
ژرژ اوربن، شیمیدان جوان و برجسته، دستگاه طیفسنجی دمارچای را به ارث برد و در سال ۱۹۰۶ دریافت که یک نمونه اکسید ایتریوم (III) آلاییده شده با اروپیم، نور قرمز بسیار روشنی ساطع میکند. این آغاز سفر طولانی مواد فسفرسانس اروپیم است - نه تنها برای ساطع کردن نور قرمز، بلکه برای ساطع کردن نور آبی نیز استفاده میشود، زیرا طیف نشری Eu2+ در این محدوده قرار میگیرد.
یک فسفر متشکل از ساطعکنندههای قرمز Eu3+، سبز Tb3+ و آبی Eu2+ یا ترکیبی از آنها، میتواند نور فرابنفش را به نور مرئی تبدیل کند. این مواد نقش مهمی در ابزارهای مختلف در سراسر جهان دارند: صفحههای تشدیدکننده اشعه ایکس، لامپهای اشعه کاتدی یا صفحههای پلاسما، و همچنین لامپهای فلورسنت کممصرف و دیودهای ساطعکننده نور اخیر.
اثر فلورسانس یوروپیوم سه ظرفیتی را میتوان توسط مولکولهای آروماتیک آلی نیز حساس کرد و چنین کمپلکسهایی را میتوان در موقعیتهای مختلفی که نیاز به حساسیت بالا دارند، مانند جوهرهای ضد جعل و بارکدها، به کار برد.
از دهه ۱۹۸۰، یوروپیوم نقش اصلی را در تجزیه و تحلیلهای بسیار حساس زیستدارویی با استفاده از روش فلورسانس سرد با تفکیک زمانی ایفا کرده است. در اکثر بیمارستانها و آزمایشگاههای پزشکی، چنین تجزیه و تحلیلی به امری عادی تبدیل شده است. در تحقیقات علوم زیستی، از جمله تصویربرداری بیولوژیکی، کاوشگرهای بیولوژیکی فلورسنت ساخته شده از یوروپیوم و سایر لانتانیدها در همه جا یافت میشوند. خوشبختانه، یک کیلوگرم یوروپیوم برای پشتیبانی از تقریباً یک میلیارد تجزیه و تحلیل کافی است - پس از آنکه دولت چین اخیراً صادرات عناصر خاکی کمیاب را محدود کرد، کشورهای صنعتی که از کمبود ذخیرهسازی عناصر خاکی کمیاب وحشتزده شده بودند، دیگر نیازی به نگرانی در مورد تهدیدات مشابه برای چنین کاربردهایی ندارند.
اکسید اروپیم به عنوان فسفر گسیل القایی در سیستم جدید تشخیص پزشکی اشعه ایکس استفاده میشود. اکسید اروپیم همچنین میتواند برای ساخت لنزهای رنگی و فیلترهای اپتوالکترونیکی، برای دستگاههای ذخیرهسازی حباب مغناطیسی و در مواد کنترل، مواد محافظ و مواد ساختاری راکتورهای اتمی استفاده شود. از آنجا که اتمهای آن میتوانند نوترونهای بیشتری نسبت به هر عنصر دیگری جذب کنند، معمولاً به عنوان مادهای برای جذب نوترونها در راکتورهای اتمی استفاده میشود.
در دنیای به سرعت در حال گسترش امروز، کاربرد اخیراً کشف شدهی یوروپیوم میتواند تأثیرات عمیقی بر کشاورزی داشته باشد. دانشمندان دریافتهاند که پلاستیکهای آلاییده شده با یوروپیوم دو ظرفیتی و مس تک ظرفیتی میتوانند به طور مؤثر بخش فرابنفش نور خورشید را به نور مرئی تبدیل کنند. این فرآیند کاملاً سبز است (رنگهای مکمل قرمز). استفاده از این نوع پلاستیک برای ساخت گلخانه میتواند گیاهان را قادر سازد تا نور مرئی بیشتری جذب کنند و بازده محصول را تقریباً 10٪ افزایش دهند.
یوروپیوم همچنین میتواند در تراشههای حافظه کوانتومی به کار رود که میتوانند اطلاعات را به طور قابل اعتمادی برای چندین روز ذخیره کنند. این تراشهها میتوانند دادههای کوانتومی حساس را در دستگاهی شبیه به هارد دیسک ذخیره کرده و به سراسر کشور ارسال کنند.
زمان ارسال: ۲۷ ژوئن ۲۰۲۳